 Jian-Kang陈
Jian-Kang陈
细胞生物学与解剖学医学系(二级)
办公室:CB2200教研楼实验室:CB2615和CB2102教研楼电话:706.721.8424实验室:706.721.1618 jchen@augusta.edu
陈氏实验室的成员
研究生:Desmond Moronge研究助理:戴彩虹,理学学士
研究兴趣
研究方法
资金的支持
美国心脏协会(AHA),美国国立卫生研究院(NIH/NIDDK),以及奥古斯塔大学乔治亚医学院的启动研究基金
研究描述
每隔30分钟,你的肾脏就会过滤掉你体内所有的血液,排出废物和多余的液体。2600万美国成年人患有肾脏疾病,而大多数人都不知道。肾脏疾病每年夺去9万多美国人的生命,比前列腺癌和乳腺癌加起来还要多。根据美国癌症协会的数据,2014年,大约有4万名女性死于乳腺癌,而29480名男性死于前列腺癌。
当你由于发育问题或手术肾消融(继发于病变肾脏、创伤或捐赠肾脏)而只有一个肾脏时,剩余肾脏中的肾单位会变大,因此单个肾脏也会变大。事实上,这种代偿性肾肥大几乎发生在所有引起肾元损伤的肾脏疾病中,从而导致功能正常的肾元数量减少。尽管代偿性肾肥大现象在一个多世纪前首次被描述,但代偿性肾肥大发生和程度的潜在信号和机制长期以来一直是一个谜。我们的实验室对确定调节代偿性肾肥大的开始和程度的生长信号和分子信号机制感兴趣。我们最初的研究表明,单侧肾切除术(UNX)bet365平台通过激活雷帕霉素(mTOR)的机制(最初是哺乳动物)靶点,诱导剩余肾脏代偿性肾肥大,如您发表在J Am Soc Nephrol. 2005 May;16(5):1384-91所述。我们的后续研究表明,S6激酶1 (S6K1)的纯合缺失可抑制UNX或糖尿病诱导的肾脏生长(Am J Physiol renal Physiol. 2009 Sep;297:F585-93)。我们进一步的研究表明,磷酸化的核糖体蛋白S6 (rpS6)是mTOR复合物1(mTORC1)-S6K1信号通路介导unx诱导的肾脏生长的主要下游效应物(kidney int2015 Mar;87:543-56)。我们在这一领域的持续和重点研究最近使我们确定了增加的氨基酸(在对侧肾脏切除后bet365平台通过增加的肾血流量传递到剩余的肾脏)作为分子生长信号,启动mTORC1-S6K1信号通路的激活,介导代偿性肾脏生长;我们还证明了不同类别的磷脂酰肌醇3-激酶(PI3K)的信号通路汇聚在mTORC1-S6K1信号的激活上,以一种依赖于上下文的方式调节肾脏大小(图1)。因此,我们的研究在分子水平上找到了一个答案,来解释这个百年问题:为什么当失去一个肾脏时,剩余的肾脏会变大?详情请参见J clinin investment .2015 Jun 1;125(6):2429-44及相关评论J clinin investment .2015 Jun 1;125:2267-70。我们最近的研究显示,在近端小管细胞特异性敲除结节性硬化症1基因(Tsc1)的小鼠中,肾脏生长惊人,Tsc1基因编码蛋白Tsc1(也称为错配蛋白),作为mTORC1的负调节因子(图2A)。我们在这一领域继续研究的目标是确定治疗靶点,以保护肾单位免受进一步损伤,以防止终末期肾病(ESRD)的发展,防止肾功能丧失,避免痛苦和昂贵的肾脏透析和移植。
我的实验室从头开始生成了酵母液泡蛋白分类缺陷34 (mVPS34)基因(Pik3c3)的哺乳动物同源物(图2B),正如我们最近在J Am Soc Nephrol. 2013 Feb;24:198-207中所记载的那样。我们现在正在以细胞类型特异性的方式定义mVPS34在肾元不同节段中的生理和病理生理作用。
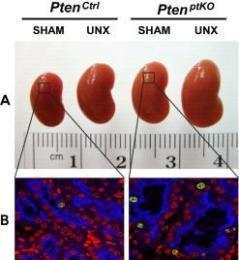
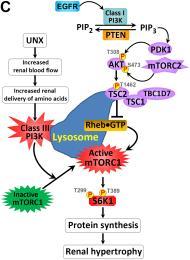
图1:(A-B)单侧肾切除术(UNX)在近端小管细胞特异性Pten敲除(PtenptKO)和Pten对照(PtenCtrl)小鼠中诱导了同等水平的代偿性肾肥大。与假手术的PtenptKO小鼠和PtenCtrl小鼠相比,UNX分别刺激了PtenptKO小鼠和PtenCtrl小鼠同等水平的肾脏肥大,如肾脏大小增加(A)和近端小管增大(B)所示。注意,肾近端小管中Pten的缺失刺激了轻微但具有统计学意义的细胞增殖,如lta阳性近端小管(蓝色)中ki67阳性细胞数量增加(绿色)所示。DAPI显示肾切片的所有核(红色)。(C)不同情况下PI3K信号调节肾脏大小的示意图。UNX引起肾血流量(RBF)增加,因此增加了游离氨基酸在剩余肾脏的肾脏传递,导致pten不依赖,但III类pi3k依赖的mTORC1易位激活到mTORC1激活物RHEB所在的溶酶体膜,激活mTORC1信号磷酸化并激活下游效应物S6K1。这导致蛋白质合成增加和肾脏肥大,而PTEN与egfr依赖的I类PI3K/mTORC2/AKT/TSC2/mTORC1/S6K1信号传导之间的相互作用介导了适当的肾脏重量/体重比。详情请参见《临床投资学报》,2015年6月1日,125(6):2429-44和《临床投资学报》,2015年6月1日,125:2267-70。
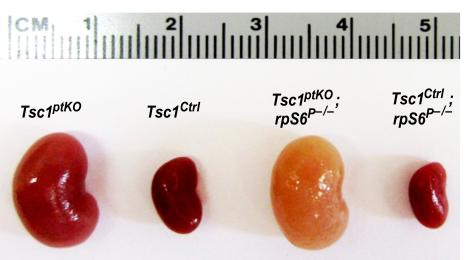
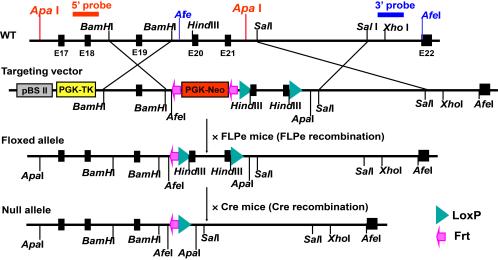
图2:(A)新一代近端小管细胞特异性Tsc1基因敲除(Tsc1ptKO)小鼠。与野生型对照小鼠(Tsc1Ctrl)相比,bet365平台Tsc1ptKO小鼠表现出显著的肾脏增大,伴有最小的膀胱发生和偶尔的显微镜下肿瘤发生。敲入Tsc1ptKO小鼠的非磷酸化核糖体蛋白S6 (rpS6P - / -)会加重膀胱发生,并引起严重的肾细胞损伤和肾纤维化。bet365平台病理改变导致肾脏变大,外观苍白。(B) mVPS34基因(Pik3c3)粘接小鼠的建立。如图所示为mVPS34基因靶向载体的结构,以及创建条件mVPS34敲除小鼠的Cre-LoxP策略。插入LoxP位点以删除Pik3c3外显子20-21,该外显子编码整个催化核心和关键DFG基序。靶向载体被设计为使mVPS34的所有远端外显子脱离阅读框,因此mVPS34的催化结构域和ATP结合结构域都被删除。
选定的出版物
1. *陈建军,Nagai K,陈杰,Plieth D, Hino M,徐军,shaf, Ikizler TA, Quarles CC, Threadgill DW, Neilson EG, *Harris RC。磷脂酰肌醇3-激酶信号决定肾脏大小。《临床投资》2015;125(6): 2429 - 44。Epub 2015年5月18日PMID: 25985273。2014影响因子13.765
*通讯作者。
2. 马SK,王Y,陈J,张MZ,哈里斯RC,陈和JK。g蛋白偶联受体40的过表达增强了对环氧二碳三烯酸的有丝分裂反应。参见PLoS One下方的PubMed Commons评论,2015年2月13日;10 (2): e0113130。doi: 10.1371 / journal.pone.0113130。eCollection 2015。PMCID: PMC4332471。2014影响因子3.534
3. 徐J,陈J,陈董Z, Meyuhas O, JK。核糖体蛋白S6磷酸化介导代偿性肾肥大。肾国际杂志2015;87(3): 543 - 56。2014年9月17日。2014影响因子8.52
4. 陈建军,陈建军,陈建军。足细胞中EGF受体缺失可减轻糖尿病肾病。中国生物医学工程学报。2015;26(5): 1115 - 25。2014年9月3日。PMCID: PMC4413759。2014影响因子9.466
5. 陈俊,陈明明,Fogo AB, Harris RC,陈建军。足细胞中MVps34缺失bet365平台通过破坏细胞内囊泡运输导致肾小球硬化。J Am Soc Nephrol. 2013 2月;24(2): 198 - 207。doi: 10.1681 / ASN.2012010101。Epub 2013年1月4日PMCID: PMC3559479。2013影响因子9.466
6. *陈建军,陈俊,陈建军,陈建军,陈建军。S6激酶1敲除抑制未肾切除术或糖尿病引起的肾肥大。contemporary medicine; 2009;297 (3): f585 - 93。PMCID: PMC2739710。*通讯作者。
7. *陈建军,陈建军,陈建军,等。哺乳动物雷帕霉素信号靶在代偿性肾肥大中的作用。中华医学杂志。2005;16(5): 1384 - 91。2005年3月23日。*通讯作者。2005影响因子7.24
8. 陈建军,Capdevila J, Harris RC。肝素结合egf样生长因子介导P450花生四烯酸环氧化酶代谢产物在上皮细胞中的生物学效应。美国国家科学基金2002年4月30日;99(9): 6029 - 34。PMCID: PMC122896。2002年影响因子10.7
9. 陈建军,陈建军,陈建军,陈建军。花生四烯酸细胞色素P450环氧合酶代谢抑制细胞凋亡。生物工程学报(英文版);21(18): 6322 - 31所示。PMCID: PMC87364。2001影响因子9.836
10. 陈建军,王大伟,Falck JR, Capdevila J, Harris RC。转染活性细胞色素P450花生四烯酸加氧酶表明,14,15-环氧二碳三烯酸作为细胞内响应表皮生长因子的第二信使。生物化学学报1999年2月19日;274(8): 4764 - 9。1999年影响因子7.666
11. 陈建军,陈建军,陈建军,陈建军。环氧二碳三烯酸及其磺胺衍生物刺激酪氨酸磷酸化并诱导肾上皮细胞有丝分裂发生。生物化学学报,1998年10月30日;273(44): 29254 - 61。PMID: 9786938。1998影响因子7.199